| ||||||||||||||||||||||||||||||||||||||||||
|
| ||||||||||||||||||||||||||||||||||||||||||
|
| ||||||||||||||||||||||||||||||||||||||||||
|
Dienstleistungen Präklinische Substanzforschung
Evaluierung des zytotoxischen Potentials von chemischen Substanzen an Tumorzelllinien Bei der Entwicklung neuer wirksamer Tumortherapeutika ist die Evaluierung
des zytotoxischen Potentials ausgewählter Substanzen, die als Therapeutika
in Frage kommen könnten, ein wichtiger Schritt
am Beginn der Medikamentenentwicklung. a) ob eine prinzipielle Wirksamkeit vorliegt, (z.b. bei grundlegend neuen, noch nicht getesteten Substanzen) oder b) welchen Einfluss Strukturvariationen bzw. -kombinationen bekannter Substanzen haben Zelllinien, die für die in vitro Testung zur Verfügung stehen:
Probenform: Feststoffe, Flüssigkeiten, Substanz abgewogen in Tube, Angaben zur Löslichkeit Probenmenge: 10 mg Mindestmenge
Leistungen:
3. Publikationsreife Auswertung der Testergebnisse nach Absprache mit dem Auftraggeber
Ansprechpartner: Prof. Dr. Reinhard Paschke
Literatur: (1) Cornelia Vetter, Christoph Wagner, Goran N. Kaluderovic´, Reinhard Paschke, Dirk Steinborn; Synthesis, characterization, and cytotoxicity of trimethylplatinum(IV) complexes with 2-thiocytosine and 1-methyl-2-thiocytosine ligands; Inorganica Chimica Acta 362 (2009) 189–195 (2) Goran N. Kaluderovic, Harry Schmidt, Sebastian Schwieger, Christoph Wagner, Reinhard Paschke, Andrea Dietrich,Thomas Mueller, and Dirk Steinborn; Platinum(IV) complexes with ethylenediamine-N,N´-diacetate dieser (R2edda) ligands: synthesis, characterization and in vitro antitumoral activity, INORGANICA CHIMICA ACTA, 361, (2008), 1395-1404 (3) Ronald Lindner, Goran N. Kaluderovic, Reinhard Paschke, Christoph Wagner, Dirk Steinborn; Synthesis and characterisation of dinuclear µ-pyrazolato-platinum(IV) complexes; (2008), Polyhedron, 27, 914–922 (4) Kaluderovic, G. N.; Schmidt, H.; Paschke, R.; Kalinowski, B.; Dietrich, A.; Mueller, T.; Steinborn, D.; Platinum(II) complexes with -methionylglycine and -methionyl--leucine ligands: Synthesis, characterization and in vitro antitumoral activity; Journal of Inorganic Biochemistry (2007), 101(3), 543-549 (5) Dietrich, A., Mueller, T., Paschke, R., Kalinowski, B., Behlendorf, T., Reipsch, F., Fruehauf, A., Schmoll, H. J., Kloft, C., and Voigt, W. (2008). 2-(4-(Tetrahydro-2H-pyran-2-yloxy)-undecyl)-propane-1,3-diamminedichloropl atinum(II): a novel platinum compound that overcomes cisplatin resistance and induces apoptosis by mechanisms different from that of cisplatin. J Med Chem 51, 5413-5422. (6) Mueller, T., Voigt, W., Simon, H., Fruehauf, A., Bulankin, A., Grothey, A., and Schmoll, H. J. (2003). Failure of activation of caspase-9 induces a higher threshold for apoptosis and cisplatin resistance in testicular cancer. Cancer Res 63, 513-521. (7) Paschke, R., Kalbitz, J., Paetz, C., Luckner, M., Mueller, T., Schmoll, H. J., Mueller, H., Sorkau, E., and Sinn, E. (2003). Cholic acid-carboplatin compounds (CarboChAPt) as models for specific drug delivery: synthesis of novel carboplatin analogous derivatives and comparison of the cytotoxic properties with corresponding cisplatin compounds. J Inorg Biochem 94, 335-342. (8) Skehan, P., Storeng, R., Scudiero, D., Monks, A., McMahon, J., Vistica, D., Warren, J. T., Bokesch, H., Kenney, S., and Boyd, M. R. (1990). New colorimetric cytotoxicity assay for anticancer-drug screening. J Natl Cancer Inst 82, 1107-1112. (9) Voigt, W. (2005). Sulforhodamine B assay and chemosensitivity. Methods
Mol Med 110, 39-48. Zur in vitro Testung von Substanzen stehen Zelllinien aus folgenden Tumorentitäten
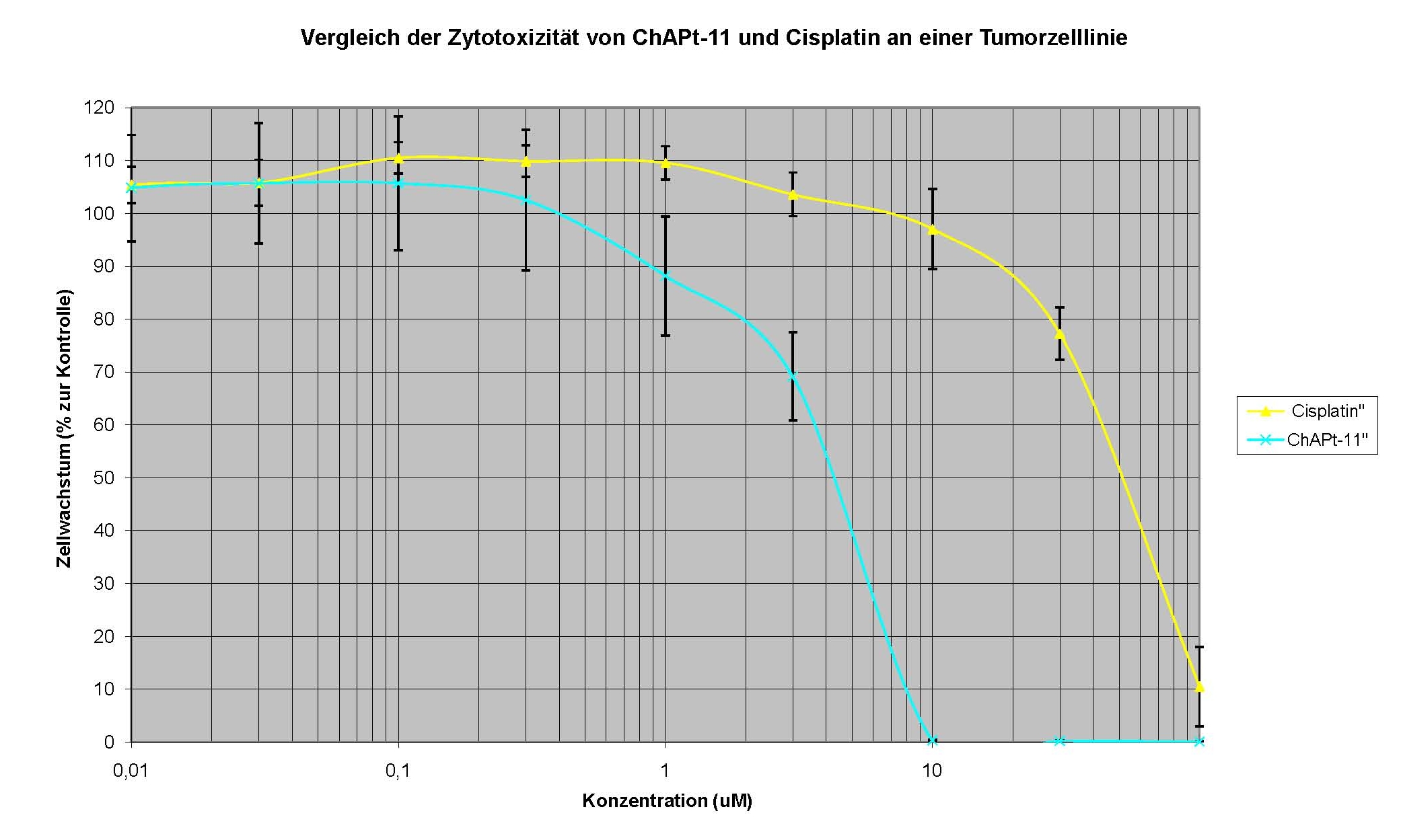
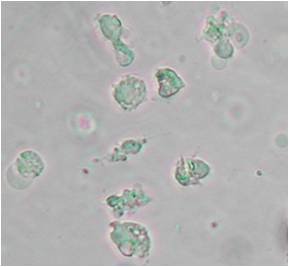
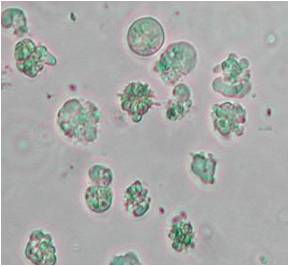
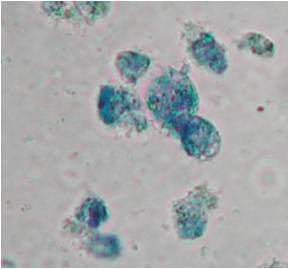
zur Verfügung: Beispiel: Evaluierung des zytotoxischen Potentials eines neuen Cisplatin-Derivates im Vergleich zu Cisplatin Diagramm der Konzentrations-Wirkungs-Beziehung: Trypanblau - Ausschlusstest
|